Анализ ПЦР у кошек: когда проводится, этапы исследования
Обновлено: 05.10.2024
Полимеразно-цепная реакция (ПЦР) - это одно из самых ярких достижений в сфере молекулярной биологии. Метод получил широчайшее распространение в разных областях науки. Благодаря очень высокой специфичности и чувствительности, метод ПЦР применяется в медицине, биологии, ветеринарии, криминалистике, санитарной службе и других отраслях деятельности человека.
Для анализа методом ПЦР можно использовать любые биологические материалы, которые содержат нуклеиновые кислоты (молекулу ДНК или РНК).
Подготовка к проведению ПЦР-теста
- Анализ сдается утром натощак. При этом ряд генетических исследований проводится в произвольное время, удобное пациенту.
- При сдаче анализа по мазку из ротоглотки необходимо выдержать интервал с приемом пищи и воды в 3-4 часа перед тестом.
- Перед анализом на венерические инфекции необходимо воздержаться от половой активности в течение суток.
- Перед анализом нельзя использовать никакие противовирусные препараты.
Выделение ДНК
Сначала пробу биологического материала подготавливают: центрифугируют, осаждают и т.д. Затем лаборантам необходимо выделить ДНК из полученного биологического концентрата.
Амплификация (увеличение числа копий ДНК)
Важнейший этап исследования. Проводится в термоциклере и именно здесь проходят все процессы, подпадающие под определение полимеразно-цепная реакция: денатурация, отжиг, элонгация.
Денатурация
Самый первый этап - развернуть (денатурировать) нуклеиновые кислоты, чтоб сделать их доступными для дальнейшей работы. Осуществляется путем нагрева реакционной смеси до 80-90 °C.
Отжиг
Денатурированные (распущенные) ДНК/РНК обрабатывают праймерами - изготовленными в лабораторных условиях коротенькими цепочками нуклеиновых кислот. Благодаря запрограммированному участку, праймеры прикрепляются только к тем нуклеиновым кислотам, для которых были созданы. Например, праймер для вируса простого герпеса 1 типа, никогда не свяжется с ДНК другого вируса, микроорганизма или клетки.
Именно праймеры обусловливают крайне высокую специфичность ПЦР - способность реагировать только на нуклеиновые молекулы конкретных типов, видов классов и даже штаммов микроорганизмов. Или отдельные виды клеток живых организмов.
Элонгация
Или синтез. После завершения процесса отжига, в реакционной смеси создают условия для активности полимеразы. Фермент, ориентируясь на молекулы праймеров (а не исходных нуклеиновых кислот), начинает синтез новых ниток ДНК/РНК. Которые становятся копиями исходных, искомых молекул нуклеиновых кислот.
Такой температурный цикл проводится 30 и более раз. В результате, даже при изначально небольшом количестве искомого генетического материала, в реакционной смеси накапливается значительное число «помеченных» праймерами нуклеиновых кислот (растет экспоненциально, с удвоением при каждом цикле).Обнаружить большие количества ДНК/РНК намного проще, за счет чего реализуется еще одно преимущество ПЦР - высочайшая чувствительность.
Детекция
Оценка результатов ПЦР проводится несколькими путями:
- Электрофорез в вязкой среде. Суть в том, что ДНК/РНК заряжены электрически и движутся к одному из электродов. В среду (агар или полиакридный гель) добавляют краситель ДНК (например - бромистый этидий). В процессе сеанса электрофореза, молекулы нуклеиновых кислот движутся и формируют скопления, подкрашенные этидием. Под ультрафиолетом, это выглядит в виде полосок разной толщины и яркости.
- Метод гибридизации. Используются праймеры, заранее помеченные люминофором (флуорофором). После нужного числа температурных циклов, применяют специальный прибор - детектор флюоресценции. За счет того, что в образец можно добавлять флуорофоры для разных мишеней (они будут и светиться под ультрафиолетом разным цветом), метод гибридизации подходит для диагностики сразу нескольких мишеней в одном образце.
- ПЦР диагностика в реальном времени (real-time PCR). Отличается тем, что детекция проводится прямо в процессе амплификации. Для этого нужны зонды-люминофоры (из предыдущего пункта) и специальные приборы ДНК-амплификаторы. Эти устройства оценивают нарастание яркости люминофора после каждого температурного цикла и впоследствии, вычисляют исходное число искомых нуклеиновых кислот в образце.
Как интерпретируется результат?
Устанавливает диагноз и делает выводы исследования только ветеринар. Самостоятельная интерпретация запрещена. Положительный результат считается при обнаружении частиц ДНК патогенного микроорганизма. Это указывает на заболевание и назначается соответствующее лечение. Отрицательным результатом является отсутствие специфических ДНК-фрагментов.
ПЦР - высокоточный метод диагностики и одно из самых главных открытий в области биологии за последние десятилетия. ПЦР-анализ применяется уже почти 40 лет и считается наиболее точным и чувствительным способом диагностики инфекционных заболеваний.
ПЦР - уникальный и универсальный метод, тест используется не только в клинической лабораторной диагностике, но также в биологии, криминалистике, археологии и многих других научных областях. Все, что нужно для проведения анализа - небольшое количество любого биоматериала пациента.
Области применения в медицине
В дерматовенерологии ПЦР используют для выявления венерических заболеваний: микоплазменной, хламидийной инфекций, сифилиса, генитального герпеса и др.
Инфекционисты активно используют ПЦР для диагностики туберкулеза, ВИЧ, вирусных гепатитов, герпеса, мононуклеоза, вируса Эпштейн-Барр и др.). А с помощью ПЦР в реальном времени, оценивая вирусную нагрузку, врачи могут составить мнение о динамике заболевания, отклике на лечение, что особенно актуально для пациентов с ВИЧ, принимающих терапию.
Также благодаря ПЦР врачи могут в течение нескольких дней с уверенностью идентифицировать коклюш и паракоклюш, выявить возбудителей эпидемии ОРВИ. Уточняются типы вируса гриппа, циркулирующие на определенной территории, на основании чего появляется возможность разработать эффективную вакцину для каждого сезона гриппа.
В течение суток или быстрее можно установить вид возбудителя кишечной инфекции, а значит - назначить адекватное лечение и обнаружить вероятный источник заражения.
Летом, ПЦР актуальна для диагностики заболеваний, передаваемых иксодовыми клещами: боррелиоза (болезни Лайма), клещевых энцефалитов.
Метод позволяет работать с любым биологическим материалом. Гемотрансмиссивные инфекции (сифилис, ВИЧ, гепатиты, боррелиоз) исследуются по пробе венозной крови или спинномозговой жидкости. Кожные болезни (герпес, грибки) - по соскобу с пораженного участка. Венерические и урологические - по образцу мочи, спермы, влагалищного отделяемого.
Так что в медицине, ПЦР применяется везде, где нужна высокая точность и быстрота получения результатов.
Если у кошки появляются симптомы болезни, хозяину предлагают сдать животному анализ ПЦР. Показанием является подозрение на такие недуги, как токсоплазмоз, панлейкопения, герпес-вирус, гельминтоз, патогенные грибки. Существует несколько видов биоматериала, необходимые для исследования, а сам анализ проводится в 4 этапа. От правильного проведения процедуры зависит результат.

По мнению ветеринаров, ПЦР-диагностика очень точная, поскольку этим методом можно определить вирус даже в самом минимальном количестве.
Как проводится ПЦР-анализ
- С обратной транскрипцией. Самый распространенный способ идентификации известной последовательности РНК, включающий амплификацию, определение патогена и его идентификации среди образцов, хранящихся в научной картотеке.
- Вложенная ПЦР (или «гнездовая») — используется для снижения количества неспецифичных продуктов реакции и имеет две стадии с использованием двух видов праймеров.
- Изотермические методы - не требуют повторяющихся температурных циклов, менее энергозатратны.
- Инвертированная ПЦР — применяется, если имеется только короткий фрагмент известной последовательности, но необходимо определить соседние последовательности после вставки ДНК в геном.
- ПЦР в реальном времени — метод, позволяющий определить не только присутствие целевой нуклеотидной последовательности в образце, но и измерять количество ее копий после каждого цикла амплификации, что дает возможность для проведения тестов с количественным результатом
Показания к проведению ПЦР-анализа
- Диагностика инфекционных заболеваний (гепатит, ВИЧ, TORCH-инфекции и огромное множество других видов патогенов).
- Урогинекология (диагностика инфекций, передающихся половым путем: хламидиоз, уреаплазма, микоплазма, кандиды, гарднерелла, герпесвирусы). Важное значение для женского и мужского здоровья играет ВПЧ - вирус папилломы человека. Доказано, что у женщин онкогенные штаммы этого вируса способны вызывать рак шейки матки.
- Неонатология. Существует целый ряд инфекций, способных поражать плод еще в материнской утробе. Среди них вирусы герпеса, токсоплазмы, краснухи. ПЦР-диагностика позволяет правильно определить тактику ведения и риски внутриутробной инфекции.
- Респираторные заболевания. Диагностика методом ПЦР стала в 2020 году актуальной как никогда и продемонстрировала свою незаменимость и эффективность. ПЦР-анализ - главный тест и «золотой стандарт» диагностики коронавирусной инфекции Sars-Cov-2 (COVID-19), ставшей причиной самой масштабной пандемии последних десятилетий.
- Генетика. Наследственные заболевания и отцовство также диагностируются при помощи метода ПЦР.
Этапы исследования
После взятия биоматериала, ПЦР у кошек проводится таким образом:
- Подготовка собранных тканей к анализу с помощью центрифугирования.
- Выделение ДНК из клеток.
- Копирование сомнительных участков ДНК-цепи с применением тестов, содержащих олигонуклеотиды, присущие отдельному возбудителю. Пробирка с добавленными образцами помещается в термостат и задается необходимая температура.
- Проводится электрофоретическая детекция, после которой ДНК-комплекс высвечивается под УФ-облучением.
Преимущества метода ПЦР
- Высокая специфичность. Метод ПЦР определяет заданную последовательность нуклеотидов, присущую конкретному патогену. Таким образом, специфичность теста стремится к 100%. Исключен риск ложноположительных результатов.
- Чувствительность. Для ПЦР достаточно всего несколько молекул ДНК патогена (или даже уже неактивных - разрушенных вирусных частиц, сохранивших специфические участки ДНК в достаточном количестве), чтобы он был обнаружен в ходе исследования.
- Скорость проведения. Лаборатория получает результат ПЦР-теста через несколько часов, клиент - уже на следующий день. Скорость диагностики имеет принципиально важное значение для своевременного лечения. Например, при диагностике бактериальных инфекций классический посев занимает от нескольких дней, а с ПЦР-анализом пациент сможет принять меры и начать лечение уже через сутки.
- Универсальность. Для исследования подходит любой биоматериал: кровь, моча, сперма, мокрота, гной, жидкости из абсцессов и пр. Кроме этого, ПЦР применяется в самых разных областях науки и медицины, работая даже там, где другие методы бессильны.
- Диагностика латентных инфекций. ПЦР-диагностика определяет возбудителя инфекции даже в инкубационном периоде и при скрытом течении заболевания.
Бактериологические методы исследования
Бактериологические исследования наиболее часто проводят при подозрении на гнойно-воспалительные заболевания (составляют 40-60% в структуре хирургических заболеваний) с целью их диагностики, изучения этиологической структуры, определения чувствительности возбудителей к антибактериальным препаратам. Результаты бактериологических анализов способствуют выбору наиболее эффективного препарата для антибактериальной терапии, своевременному проведению мероприятий для профилактики внутрибольничных инфекций.
Возбудителями гнойно-воспалительных заболеваний являются истинно-патогенные бактерии, но наиболее часто условно-патогенные микроорганизмы, входящие в состав естественной микрофлоры человека или попадающие в организм извне. Истинно-патогенные бактерии в большинстве случаев способствуют развитию инфекционного заболевания у любого здорового человека. Условно-патогенные микроорганизмы вызывают заболевания преимущественно у людей с нарушенным иммунитетом.
Бактериологические исследования при заболеваниях, вызываемых условно-патогенными микроорганизмами, направлены на выделение всех микроорганизмов, находящихся в патологическом материале, что существенно отличает их от аналогичных исследований при заболеваниях, вызванных истинно патогенными микроорганизмами, когда проводится поиск определенного возбудителя.
Для получения адекватных результатов бактериологического исследования при гнойно-воспалительных заболеваниях особенно важно соблюдать ряд требований при взятии биоматериала для анализа, его транспортировки в лабораторию, проведения исследования и оценки его результатов.
- микроскопическое исследование мазка (бактериоскопия) из доставленного биоматериала;
- выращивание культуры микроорганизмов (культивирование);
- идентификацию бактерий;
- определение чувствительности к антимикробным препаратам и оценку результатов исследования.
Доставленный в бактериологическую лабораторию биоматериал первоначально подвергается микроскопическому исследованию.
Микроскопическое исследование мазка (бактериоскопия), окрашенного по Граму или другими красителями, проводят при исследовании мокроты, гноя, отделяемого из ран, слизистых оболочек (мазок из цервикального канала, зева, носа, глаза). Результаты микроскопии позволяют ориентировочно судить о характере микрофлоры, ее количественном содержании и соотношении различных видов микроорганизмов в биологическом материале, а также дают предварительную информации об обнаружении этиологически значимого инфекционного агента в данном биоматериале, что позволяет врачу сразу начать лечение (эмпирическое). Иногда микроскопия позволяет выявить микроорганизмы, плохо растущие на питательных средах. На основании данных микроскопии проводят выбор питательных сред для выращивания микробов, обнаруженных в мазке.
Культивирование микроорганизмов. Посев исследуемого биоматериала на питательные среды производят с целью выделения чистых культур микроорганизмов, установления их вида и определения чувствительности к антибактериальным препаратам. Для этих целей используют различные питательные среды, позволяющие выделить наибольшее количество видов микроорганизмов. Оптимальными являются питательные среды, содержащие кровь животного или человека, а также сахарный бульон, среды для анаэробов. Одновременно производят посев на дифференциально-диагностические и селективные (предназначенные для определенного вида микроорганизмов) среды. Посев осуществляют на стерильные чашки Петри, в которые предварительно заливают питательную среду для роста микроорганизмов.

Микроскопия мазков, окрашенных по Граму
1 - стрептококки; 2 - стафилококки; 3 - диплобактерии Фридленда; 4 - пневмококки
Колонии отсевают на плотные, жидкие, полужидкие питательные среды, оптимальные для культивирования определенного вида бактерий.
Выделенные чистые культуры микроорганизмов подвергают дальнейшему изучению в диагностических тестах, основанных на морфологических, ферментативных, биологических свойствах и антигенных особенностях, характеризующих бактерий соответствующего вида или варианта.
Идентификация - это комплекс бактериологических методов изучения бактерий, позволяющий определить вид микроорганизма. В Лаборатории «Ситилаб» идентификация большинства видов бактерий и грибов осуществляется на автоматическом бактериологическом анализаторе с использованием диагностических панелей зарубежного производства: на бланке результата исследования в виде наименования микроорганизма или его рода, например, Streptococcus pneumoniae (пневмококк) или Eschrichia coli (кишечная палочка).
Определение чувствительности к антибактериальным препаратам. Чувствительность к антимикробным препаратам изучают у выделенных чистых культур микроорганизмов, имеющих этиологическое значение для данного заболевания. Поэтому в направлении на бактериологические анализы требуется указать диагноз заболевания у больного. Определение чувствительности бактерий к спектру антибиотиков помогает лечащему врачу правильно выбрать препарат для лечения больного.
В Лаборатории «Ситилаб» определение чувствительности выделенной чистой культуры большинства видов бактерий и грибов осуществляется на автоматическом бактериологическом анализаторе с использованием диагностических панелей зарубежного производства к широкому спектру современных антибактериальных препаратов (от 6 до 32 препаратов, в зависимости от выделенного микроорганизма) с определением минимальной ингибирующей концентрации (МИК). На бланке результатов определения чувствительности к антибактериальным препаратам обозначение R указывает на резистентность, I - умеренную чувствительность, S - чувствительность микроорганизма к данному препарату.
Оценка результатов исследования. Принадлежность условно-патогенных микроорганизмов к естественной микрофлоре организма человека создает ряд трудностей при оценке их этиологической роли в развитии гнойно-воспалительных заболеваний. Условно-патогенные микроорганизмы могут представлять нормальную микрофлору исследуемых жидкостей и тканей или контаминировать их из окружающей среды. Поэтому для правильной оценки результатов бактериологических исследований необходимо знать состав естественной микрофлоры изучаемого образца. В тех случаях, когда исследуемый биоматериал в норме стерилен, как, например, спинномозговая жидкость, экссудаты, все выделенные из него микроорганизмы могут считаться возбудителями заболевания. В тех случаях, когда исследуемый материал имеет собственную микрофлору, как, например, отделяемое влагалища, кал, мокрота, нужно учитывать изменения ее качественного и количественного состава, появление несвойственных ему видов бактерий, количественную обсемененность биоматериала. Так, например, при бактериологическом исследовании мочи степень бактериурии (число бактерий в 1 мл мочи), равная и выше 10 5 , свидетельствует об инфекции мочевых путей. Более низкая степень бактериурии встречается у здоровых людей и является следствием загрязнения мочи естественной микрофлорой мочевых путей.
Установить этиологическую роль условно-патогенной микрофлоры помогают также нарастание количества и повторность выделения бактерий одного вида от больного в процессе заболевания.
Врач-клиницист должен знать, что положительный результат бактериологического исследования в отношении биологического материала, полученного из в норме стерильного очага (кровь, плевральная жидкость, спинномозговая жидкость, пунктат органа или ткани), всегда тревожный результат, требующий немедленных действий по оказанию медицинской помощи.
Как это все происходит в лаборатории

Суть метода ПЦР
ПЦР - полимеразная цепная реакция. Метод основан на обнаружении даже небольших концентраций искомого элемента диагностики. Для определения изначально крайне малых концентраций РНК или ДНК, которые необходимо определить в процессе проведения основного этапа исследования, используется метод искусственного увеличения количества РНК или ДНК. А поскольку они специфичны и строго индивидуальны для каждого микроорганизма или живого существа за счет уникальности последовательности нуклеотидов во фрагментах, ошибка в определении целевого ДНК или РНК исключена.
Генетическая информация любого живого организма записывается в ДНК. Эта молекула состоит из двух цепочек, сплетающихся в единую спираль. Некоторые вирусы (например, COVID-19) хранят свой код в РНК - одной нити нуклеотидов.
Для каждого организма, включая вирусы, бактерии и грибки, последовательность нуклеотидов уникальна. Ее можно сравнить с отпечатком пальца или сканом сетчатки глаза человека. Укороченные последовательности нуклеотидов, характерные для каждого вида патогена (возбудителя опасных заболеваний), хранятся в базах научных лабораторий в виде праймеров - отдельных участков ДНК, типичных для только конкретного возбудителя. Эти участки значительно короче любой молекулы ДНК. Такие праймеры присоединяются к ДНК возбудителя в пробе и под действием катализаторов многократно воспроизводят свои дубли. Этот процесс называются «репликация» - многократное увеличение, дублирование искомого участка до тех пор, пока он не станет доступен для определения. Процесс репликации возможен только при наличии в пробе ДНК возбудителя.
Когда проводится анализ?
Исследование ПЦР имеет несколько разновидностей и назначается котам при заболеваниях, показанных в таблице:
| Название комплекса | При каких недугах проводится |
|---|---|
| Респираторный | Ринотрахеит |
| Токсоплазмоз | |
| Микоплазмоз | |
| Аденовирус | |
| Заражение хламидиями | |
| Вирусный | Панлейкопения |
| Вирус иммунодефицита | |
| Вирусная лейкемия или перитонит | |
| Инфекционная анемия | |
| Инфекции слизистых | Стафилококк или стрептококк |
| Папиллома ½ типа | |
| Урогенитальный | Заражение патогенными грибками и хламидиями |
| Цитомегаловирус | |
| Уреаплазмоз | |
| Инфекции, вызванные клещами | Бабезиоз |
| Риккетсиоз | |
| Анаплазмоз | |
| Стоматологический | Актиномицеты |
| Гингивалис при стоматите, кариесе, патологическом расшатывании зубов | |
| Дерматологический | Дерматиты любой этиологии (трихофитон, малассезия, микроспорум) |
| Бактриально-дерматологический | Бактериальное поражение кожи, такими как стафилококк, стрептококк, микроорганизмы группы кишечной палочки |
| Паразитарный | Заражение сосальщиком, анкилостомой, токсокарой для выявления гельминтоза |
Кому мы обязаны появлением метода ПЦР?
Со слов американского биохимика Керри Мюллиса (Kary Mullis), идея идентифицировать живые организмы по короткому участку их генетического кода (ДНК) пришла ему в голову в 1983 году, по пути с работы домой. А в основе этой идеи, лежала работа другого американского биохимика, Артура Корнберга (Arthur Kornberg), которая в свое время не нашла отклика у научного сообщества.
Керри допустил возможность того, чтобы взять молекулу ДНК какого-либо организма, с помощью высокой температуры «распустить» ее спираль на две нити, специфическими маркерами-праймеры пометить уникальные для этого микроорганизма участки ДНК и затем, применив фермент ДНК-полимеразу, создать из двух нитей две новые молекулы ДНК. Но уже содержащие в себе меченные праймеры. И потом останется просто искать эти участки в диагностическом материале.
В итоге, корпорация CETUS, в которой работал Мюлис, выделила ему команду ученых. И в 1985 году, в издании Американского общества генетики человека, появилась публикация с теоретическим обоснованием ПЦР, как метода идентификации генетического материала живых организмов.
Серологические методы исследования
В основе всех серологических реакций лежит взаимодействие антигена и антитела. Серологические реакции используются в двух направлениях.
1. Обнаружение с диагностической целью антител в сыворотке крови обследуемого. В этом случае из двух компонентов реакции (антитело, антиген) неизвестным является сыворотка крови, так как постановка реакции проводится с заведомо известными антигенами. Положительный результат реакции свидетельствует о наличии в крови антител, гомологичных применяемому антигену; отрицательный результат указывает на отсутствие таковых. Достоверные результаты получают при исследовании «парных» сывороток крови больного, взятой в начале заболевания (3-7-й день) и через 10-12 дней. В этом случае удается наблюдать динамику нарастания антител. При вирусных инфекциях лишь четырехкратное и большее повышение титра антител во второй сыворотке имеет диагностическое значение.
2. Установление родовой и видовой принадлежности микроба или вируса. В этом случае неизвестным компонентом реакции является антиген. Такое исследование требует постановки реакции с заведомо известными иммунными сыворотками.
Серологические исследования не обладают 100%-й чувствительностью и специфичностью в отношении диагностики инфекционных заболеваний, могут давать перекрестные реакции с антителами, направленными к антигенам других возбудителей. В связи с этим оценивать результаты серологических исследований необходимо с большой осторожностью и учетом клинической картины заболевания. Именно этим обусловлено использование для диагностики одной инфекции множества тестов, а также применение метода Western-blot для подтверждения результатов скрининговых методов.
В последние годы прогресс в области серологических исследований связан с разработкой тест-систем для определения авидности специфических антител к возбудителям различных инфекционных заболеваний.
Авидность - характеристика прочности связи специфических антител с соответствующими антигенами. В ходе иммунного ответа организма на проникновение инфекционного агента стимулированный клон лимфоцитов начинает вырабатывать сначала специфические IgM-антитела, а несколько позже и специфические IgG-антитела. IgG-антитела обладают поначалу низкой авидностью, то есть достаточно слабо связывают антиген.
Затем развитие иммунного процесса постепенно (это могут быть недели или месяцы) идет в сторону синтеза лимфоцитами высокоспецифичных (высокоавидных) IgG-антител, более прочно связывающихся с соответствующими антигенами. На основании этих закономерностей иммунного ответа организма в настоящее время разработаны тест-системы для определения авидности специфических IgG-антител при различных инфекционных заболеваниях.
Высокая авидность специфических IgG-антител позволяет исключить недавнее первичное инфицирование и тем самым с помощью серологических методов установить период инфицирования пациента. В клинической практике наиболее широкое распространение нашло определение авидности антител класса IgG при токсоплазмозе и цитомегаловирусной инфекции, что дает дополнительную информацию, полезную в диагностическом и прогностическом плане при подозрении на эти инфекции, в особенности при беременности или планировании беременности.
Преимущества методики ПЦР
Всего разработано более 10 разных методик амплификации, применяемых лабораториями в зависимости от исходных условий и поставленных целей.
Общим для них есть высокая чувствительность (для положительного результата достаточно 40 (!) или менее искомых копий ДНК в 1 мл образца, то есть вероятность ложноотрицательного ответа ничтожно мала. И очень высокая специфичность: вероятность ложноположительного ответа составляет менее 1%.
Но точность результатов сильно зависит от качества сбора диагностического материала, тщательного соблюдения всех технических требований к каждому этапу и качеству оборудования, расходных материалов (буфера, праймеров, раствора для отмывки и т.д.).

Что такое ПЦР и как проводится?
Полимеразная цепная реакция позволяет выявить возбудителя инфекционных недугов или гельминтоза. Для проведения анализа применяются специальные ферменты, которые вводят в пробы собранного материала. Вещество копирует ДНК болезнетворного микроба. Затем полученные фрагменты соотносят с видом микроорганизма, занесенного в базу данных, а также определяется его количество в биоматериале. Это позволяет обнаружить возбудителя на клеточном уровне или если его антигенная изменчивость повышена. Для проведения анализа подходит следующий биоматериал:
- Кровь.
- Соскоб со слизистых глаз, носа, ротовой полости, влагалища.
- Кал. Собирают из предварительно очищенного лотка и упаковывают в контейнер.
- Урина. При заборе может потребоваться проведение цистоцентеза.
Результаты ПЦР-теста
Результаты анализов, проведенных методом ПЦР, известны уже через один день. Иногда возможно проведение экстренного теста - его часто используют при оказании срочной медицинской помощи при госпитализации. Тогда срок готовности результата сокращается до считанных часов.
Результаты ПЦР-теста дадут точную информацию о том, какая инфекция была обнаружена. При количественном тестировании анализ определит также вирусную или бактериальную нагрузку на организм. В этом случае в результатах будет значиться титр обнаруженного патогена (его количество в одном миллилитре пробы). Количественный анализ особенно важен при диагностике заболеваний, спровоцированных условно-патогенными микроорганизмами, которые присутствуют в норме практически у каждого человека. Такие микроорганизмы представляют угрозу только при большой численности, а в остальных случаях мирно сосуществуют с носителем.
Диагностика инфекционных заболеваний является одной из самых сложных проблем в клинической медицине. Лабораторные методы исследования при ряде нозологических форм играют ведущую, а в целом ряде клинических ситуаций решающую роль не только в диагностике, но и в определении конечного исхода заболевания.
Диагностика инфекционных заболеваний почти всегда предусматривает использование комплекса лабораторных методов. 
- бактериологические;
- серологические;
- метод полимеразной цепной реакции (ПЦР) для обнаружения ДНК или РНК возбудителя инфекционного заболевания в исследуемом материале.
У одних пациентов для диагностики этиологии инфекционно-воспалительного процесса достаточно провести бактериологическое исследование, в других клинических ситуациях решающее значение имеют данные серологических исследований, в третьих, предоставить полезную информацию может только метод ПЦР. Однако наиболее часто в клинической практике врачу-клиницисту необходимо использовать данные различных методов лабораторных исследований.
Какие есть недостатки
Единственный серьезный недостаток, связанный с методом полимеразной цепной реакции, - его высокая технологичность. Исследования ПЦР требуют строжайших соблюдений правил и серьезной оснащенности лабораторного комплекса. Не каждая лаборатория может позволить себе все необходимое оборудование.Метод полимеразной цепной реакции
Полимеразная цепная реакция (ПЦР), являющаяся одним из методов ДНК-диагностики, позволяет увеличить число копий детектируемого участка генома (ДНК) бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы. Тестируемый специфический для данного генома отрезок нуклеиновой кислоты многократно умножается (амплифицируется), что позволяет его идентифицировать.
Сначала молекула ДНК бактерий или вирусов нагреванием разделяется на 2 цепи, затем в присутствии синтезированных ДНК-праймеров (последовательность нуклеотидов специфична для определяемого генома) происходит связывание их с комплементарными участками ДНК, синтезируется вторая цепь нуклеиновой кислоты вслед за каждым праймером в присутствии термостабильной ДНК-полимеразы. Получается две молекулы ДНК. Процесс многократно повторяется. Для диагностики достаточно одной молекулы ДНК, то есть одной бактерии или вирусной частицы.
Введение в реакцию дополнительного этапа - синтеза ДНК на молекуле РНК при помощи фермента обратной транскриптазы - позволило тестировать РНК-вирусы, например, вирус гепатита С. ПЦР - это трехступенчатый процесс, повторяющийся циклично: денатурация, отжиг праймеров, синтез ДНК (полимеризация). Синтезированное количество ДНК идентифицируют методом иммуноферментного анализа или электрофореза.
В ПЦР может быть использован различный биологический материал - сыворотка или плазма крови, соскоб из уретры, биоптат, плевральная или спинномозговая жидкость и т.д. В первую очередь ЦПР применяют для диагностики инфекционных болезней, таких как вирусные гепатиты В, С, D, цитомегаловирусная инфекция, инфекционные заболевания, передающиеся половым путем (гонорея, хламидийная, микоплазменная, уреаплазменная инфекции), туберкулез, ВИЧ-инфекция и т.д.
Желудочно-кишечный большой профиль (вирус панлейкопении (FPV), коронавирус кошек (FCoV), токсоплазма (Toxoplasma gondii), гиардиа (Giardia spp.), криптоспоридии (Cryptosporidium spp.), тritrichomonas blagburni (foetus))
Цена от 100 руб.
Желудочно-кишечный профиль (вирус панлейкопении (FPV), коронавирус кошек (FCoV), токсоплазма (Toxoplasma gondii))
Цена от 100 руб.
Желудочно-кишечный профиль (вирус панлейкопении (FPV), коронавирус кошек (FCoV), токсоплазма (Toxoplasma gondii))
Цена от 100 руб.
Желудочно-кишечный стандартный профиль (вирус панлейкопении (FPV), коронавирус кошек (FCoV), токсоплазма (Toxoplasma gondii), гиардиа (Giardia spp.), криптоспоридии (Cryptosporidium spp.))
Цена от 100 руб.
Кровепаразитарный профиль (анаплазма (A. phagocytophilum и A.platys), бабезия (Babesia spp.), эрлихия (E. canis))
Цена от 100 руб.
Паразитарный профиль при хронической диарее (гиардиа (Giardia spp.), криптоспоридии (Cryptosporidium spp.), тritrichomonas blagburni (foetus))
Цена от 100 руб.
Респираторный большой профиль (бордетелла (вordetella bronchiseptica), герпесвирус кошек (FHV-1), калицивирус (FCV), микоплазма (M. felis), хламидия (C. felis))
Цена от 100 руб.
Респираторный малый профиль (бордетелла (вordetella bronchiseptica), герпесвирус кошек (FHV-1), калицивирус (FCV))
Цена от 100 руб.
Стоматологический большой профиль (вирус иммунодефицита (FIV, обнаружение провирусной ДНК), вирус лейкемии (FeLV, обнаружение провирусной ДНК), калицивирус (FCV), бартонелла (Bartonalla spp.))
Цена от 100 руб.
Стоматологический малый профиль (вирус иммунодефицита (FIV, обнаружение провирусной ДНК), вирус лейкемии (FeLV, обнаружение провирусной ДНК), калицивирус (FCV))
Цена от 100 руб.
Хронические вирусные инфекции (вирус иммунодефицита (FIV, обнаружение провирусной ДНК), вирус лейкемии (FeLV, обнаружение провирусной ДНК))
ПЦР-диагностика. Профили для кошек и другие ветеринарные исследования в лаборатории VET UNION в Москве. Качественные и достоверные анализы по оптимальной цене.
Каталог наполняется. На данный момент не во всех исследованиях есть подробное описание. Приносим извинения за временные неудобства.
Специалисты

Чагаева Мария Александровна
лаборант, группа гистологии
Отделение: Отдел гистологи и цитологии
Образование (ВУЗ): Южный филиал Национального университета биоресурсов и природопользования (КАТУ ЮФ НАУ им. Вернадского)
Стаж работы: 12 лет

Соколова Ксения Андреевна
ветеринарный врач
Отделение: Отделение общеклинических исследований биохимии и иммунохимии
Образование (ВУЗ): ФГБОУ ВПО "Московская государственная академия ветеринарной медицины и биотехнологии К.И. Скрябина"
Стаж работы: 3 года

Масленников Сергей Сергеевич
лаборант, группа гистологии
Отделение: Отдел гистологи и цитологии
Образование (ВУЗ): ФГОУ ВПО "Московская государственная академия ветеринарной медицины и биотехнологии им.К.И. Скрябина
Стаж работы: 13 лет

Мужикян Арман Артушович
внешний исполнитель, группа гистологии
Отделение: Отдел гистологи и цитологии
Образование (ВУЗ): ФГБОУ ВПО Санкт-Петербургская государственная академия ветеринарной медицины (СПбГАВМ)
Стаж работы: 8 лет

Богомолова Ирина Владимировна
специалист, группа гистологии
Отделение: Отдел гистологи и цитологии
Образование (ВУЗ): ФГБОУ ВПО "Московская государственная академия ветеринарной медицины и биотехнологии К.И. Скрябина"
Стаж работы: 12 лет

Мамонтова Лидия Евгеньевна
старший ветеринарный врач
Отделение: Отдел молекулярной диагностики
Образование (ВУЗ): ФГБОУ ВПО "Московская государственная академия ветеринарной медицины и биотехнологии К.И. Скрябина"
Стаж работы: 5 лет

Буланова Светлана Александровна
лаборант, группа гистологии
Отделение: Отдел гистологи и цитологии
Образование (ВУЗ): ФГБОУ ВПО "Московская государственная академия ветеринарной медицины и биотехнологии К.И. Скрябина"
Стаж работы: 3 года

Филиппова Ольга Александровна
старший ветеринарный врач
Отделение: Отделение общеклинических исследований биохимии и иммунохимии
Образование (ВУЗ): ФГБОУ ВПО "Московская государственная академия ветеринарной медицины и биотехнологии К.И. Скрябина"
Стаж работы: 11 лет

Мосунова Юлия Владимировна
ветеринарный врач
Отделение: Отделение общеклинических исследований биохимии и иммунохимии
Образование (ВУЗ): ФГБОУ ВПО "Московская государственная академия ветеринарной медицины и биотехнологии К.И. Скрябина"
Стаж работы: 5 лет
Бактериальные и вирусные заболевания — одни из наиболее часто встречающихся заболеваний домашних животных. Это, например, пироплазмоз, лептоспироз, гепатит, чумка, герпесвирус, калицивироз, хламидиоз и др.
До настоящего времени диагностика таких заболеваний вызывала затруднения, поскольку существующие виды анализов из-за их малой доступности не нашли широкого применения в ветеринарии. Зачастую работа по диагностике и лечению вирусных и бактериальных инфекций строится на основании одних лишь симптомов заболевания и личного опыта врача. При этом нужно учитывать, что часто различные вирусы и бактерии могу вызывать одинаковые симптомы заболевания. Разумеется, рассчитывать на высокую эффективность лечения при таких условиях невозможно. Но с появлением нового диагностического инструмента — анализа ПЦР — ситуация существенно изменилась! Теперь на основании данного анализа ветврач может точно определить заболевание и назначить эффективное лечение или скорректировать уже проводимое.
С октября 2016 г. ПЦР-диагностика вирусных и бактериальных заболеваний проводится и в лабораториях клиник «Доктор Вет»!
ПЦР (полимеразная цепная реакция) — высокоточный метод диагностики многих инфекций, который основывается на исследовании генетического материала животных (ДНК и РНК). Это один из самых точных и чувствительных методов диагностики инфекционных заболеваний.
ДОСТОИНСТВА МЕТОДА
Универсальность. ПЦР позволяет обнаруживать любые ДНК и РНК, даже когда бессильны другие методы.
Специфичность. При поиске определяется вид конкретного возбудителя. Кроме того в одном биологическом материале, возможен поиск нескольких возбудителей без ущерба для качества полученных данных.
Чувствительность. Результат будет получен даже при минимальном содержании возбудителя в материале, например, на начальной стадии заболевания или если заболевание не вылечено окончательно. А лечение болезни на раннем этапе значительно повышает эффективность и скорость выздоровления пациента, предотвращает риски осложнений.
Оперативность. Результат анализа готов уже через сутки.
К недостаткам метода можно отнести лишь осторожность, с которой врач должен относиться к интерпретации результатов. Так, не всегда положительный ответ ПЦР означает наличие заболевания. После проведения лечения контроль необходим через время, а не сразу, так как погибший и уже не опасный возбудитель будет еще некоторое время «разбираться на запчасти» защитной системой организма и «показываться» в анализе. Отрицательный же результат ПЦР при наличии явной клинической картины может означать, что материал для исследования был взят не правильно.
Так как все инфекции собак и кошек можно разделить на несколько групп: системные, кровопаразитарные, офтальмологические, респираторные, дерматофитозные, половые, желудочно-кишечные, то и забор материала должен проводиться с соответствующих мест. Материалом для исследования может служить: кровь, слюна, мокрота, фекалии, соскобы и суспензии клещей.
Несмотря на вышеуказанные трудности ПЦР остается наиболее доступным и совершенным на сегодняшний день приемом диагностики.
КАКИЕ ЗАБОЛЕВАНИЯ ОПРЕДЕЛЯЮТСЯ МЕТОДОМ ПЦР?
В клиниках «Доктор Вет» проводят исследования методом ПЦР на выявление следующих инфекций.
- Герпесвирусная инфекция — приводит к абортам, высокой смертности новорожденных (инфицирование почти в 60% случаев).
- Калицивирус — тяжело протекает у котят, в то же время 25-80% переболевших взрослых животных становятся носителями и являются источником заражения, передавая вирус через слюну.
- Панлейкопения — вирусное заболевание кошек, характеризующееся резким падением уровня лейкоцитов, гастроэнтеритом, ринитами с конъюнктивитами, высокой смертностью (30-90 %) заболевших котят.
- 4. Короновирусная инфекция — тяжелое заболевание, возбудителем которого является РНК-содержащий высокопатогенный вирус.
- Иммунодефицит кошек и лейкемия кошек — вирус поражает иммунную и нервную системы.
- Аденовирус и чума плотоядных у собак проявляется комплексом симптомов: лихорадка, конъюнктивиты и ринотрахеиты, расстройство желудочно-кишечного тракта, поражение нервной системы.
- Токсоплазмоз — промежуточными хозяевами могут быть кошка, собака, человек. Клинические симптомы зависят от пораженных органов: могут наблюдаться неврологические нарушения (тремор, паралич) или нарушения походки, атрофия мышц, а также миокардит и гепатит.
- Хламидиоз — у кошек заболевание проявляется в основном в форме гнойных и негнойных конъюнктивитов и кератитов, также могут наблюдаться ринит, пневмония, вагинит, аборты и бесплодие. У котят встречается конъюнктивит. У собак симптомы разнообразны и проявляются воспалительными заболеваниями конъюнктивы, половых органов, гастритами, артритами, абортами и бесплодием. Есть данные о роли хламидий в развитии атеросклероза у собак.
- Микоплазмоз — протекает с признаками бронхопневмонии, кератоконъюктевитов и кератитов.
- Пироплазмоз, анаплазмоз, боррелиоз — заболевания, переносимые клещами.
Все перечисленные заболевания очень коварны, так как легко и быстро передаются от больных животных здоровым (а также людям) и имеют высокий показатель смертности при отсутствии должного лечения.
ПЦР-метод позволяет гарантированно обнаруживать даже единичных возбудителей в биологическом материале за короткий промежуток времени, благодаря чему врач может поставить точный диагноз, назначить адекватное лечение и разработать профилактические мероприятия.
Коронавирусные инфекции кошек и собак вызываются представителями рода Coronavirus (семейство Coronaviridae). Основным проявлением коронавирусной инфекции у собак является диарея. V кошек коронавирусы вызывают энтериты и инфекционный перитонит, широко распространенные среди диких и домашних кошек.
Возбудителем коронавирусной инфекции у собак является Canine coronavirus, вызывающий острый коронавирусный энтерит. Заболевание передается при непосредственном контакте с носителем вируса (через слюну и фекалии). Данной инфекции подвержены собаки любого возраста, однако чаще всего поражаются щенки и ослабленные животные, которые уже перенесли другую болезнь, например парвовирусную инфекцию.
Основные симптомы заболевания — рвота и диарея, иногда с примесью крови, обезвоживание организма, потеря в весе, апатия. Через 3-4 недели после выздоровления может развиться повторное заболевание. При проведении диагностики коронавирусный энтерит собак необходимо дифференцировать от парвовирусного энтерита, аденовирусной инфекции кишечного типа и чумы плотоядных.
Коронавирусы, поражающие кошек, представлены двумя биотипами: FECV, или коронавирус энтерита кошек, и FIPV — вирус инфекционного перитонита кошек (2, 3). Носителями FECV является 16-50% домашних кошек, у которых вирус локализуется в тонком кишечнике, не вызывая заболевания или становясь причиной легкой диареи. В то же время у 5-12% носителей может наблюдаться мутация условно-патогенной кишечной формы FECV в патогенную (FIPV), что приводит к развитию болезни (2).
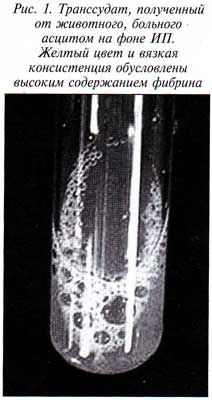


Сухая (неэкссудативная) форма ИП протекает без скопления жидкости в брюшной и грудной полостях. В этом случае страдают внутренние органы — головной мозг (рис. 4), печень, почки, поджелудочная железа, в 25% случаев наблюдаются поражения глаз (рис. 5) (5).
Поскольку эффективная схема лечения ИП пока не разработана, первостепенное значение имеют профилактические меры, направленные на раннее выявление вирусоносительства (1, 3).
Материалы и методы
В исследовании был использован штамм коронавируса «Багира» (5 1оg ТЦД50/мл) в разведениях, 8 изолятов коронавирусов кошек (FCoV), 2 изолята коронавируса собак (CCV) и суспензии вируса панлейкопении кошек и калицивируса кошек.
При испытании ПЦР-тест-системы использовался биологический материал здоровых кошек, животных с клиническими признаками ИП и кошек с неспецифическими симптомами. Среди исследованных животных были как содержащиеся в питомниках, так и находящиеся на индивидуальном содержании.
Биологический материал параллельно исследовался методами ПЦР и РИГА. С помощью ПЦР-системы исследовались фекалии, плазма крови, транссудат при специфическом асците, а методом РИГА — сыворотка крови и транссудат.
Однако данное исследование требует значительных затрат времени и средств. В связи с этим эффективным методом диагностики ИП может служить полимеразная цепная реакция (ПЦР), которая позволяет не только выявлять коронавирусы кошек, но и проводить дифференциацию условно-патогенных и патогенных штаммов исходя из различной локализации их в организме. При этом обнаружение вируса в фекалиях кошек свидетельствует о носительстве условно-патогенных штаммов (FECV), а в плазме крови или асцитной жидкости — о циркуляции в организме животного патогенных штаммов (FIPV) и, следовательно, о заболевании.
Цель настоящего исследования — испытание тест-системы для диагностики коронавирусной инфекции у кошек и собак на основе ПЦР.
Выделение РНК проводилось с использованием набора «РНК-сорб» (ЦНИИЭ), в основе которого лежит метод ее сорбции на силикагеле. ПЦР проводилась на амплификаторе ТЕРЦИК («ДНК-технология») по стандартной методике. Полученные ПЦР-продукты визуализировались методом электрофореза в 1,5% агарозном геле, содержащем бромистый этидий.
Результаты и обсуждение
В процессе исследования проведен анализ сведений о нуклеотидных последовательностях представителей семейства Coronaviridae, в частности различных изолятов коронавирусов кошек и собак, опубликованных в базах данных Entrez, GeneBank, EMBL и DDBJ. Кроме того, изучена литература, характеризующая структуру геномов FCoV, CCV и их генетическое родство с другими представителями семейства.
В качестве мишеней для специфических праймеров были выбраны две консервативные последовательности в гене нуклеокапсидного протеина. Специфичность предложенных праймеров изучалась с помощью компьютерных программ FASTA и BLASTA. В результате проведенной работы была выявлена гомология выбранных олигонуклеотидов только с генами нуклеокапсидного протеина FCoV и CCV и не обнаружено их значимой гомологии с нуклеотидными последовательностями иных видов семейства Coronaviridae, а также каких-либо других вирусов, бактерий или эукариот. Таким образом, предложенные праймеры, исходя из теоретических расчетов, должны обладать 100% специфичностью.
На следующем этапе исследования были оптимизированы условия выделения РНК вируса и проведения реакции обратной транскрипции и ПЦР, а также определены специфичность и чувствительность ПЦР-анализа. Размер ПЦР-продукта составил 350 пар нуклеотидов. Метод показал 100% специфичность и высокую чувствительность. Обнаружение коронавируса в фекалиях кошек свидетельствовало о носительстве его условно-патогенных штаммов в кишечнике, обнаружение FECV в транссудате и плазме крови — о развитии заболевания.
При исследовании методом РНГА положительным результатом считалось обнаружение у животного титра антител > 1:128. Однако это могло указывать как на вирусоносительство, так и на манифестированную форму инфекции. Кроме того, положительный титр мог быть обусловлен наличием контакта с коронавирусом ранее. В качестве материала от собак исследовались фекалии, и обнаружение в них РНК коронавируса свидетельствовало о заболевании, вызванном CCV.
В ходе эксперимента был исследован биологический материал, взятый у 193 кошек (таблица). Методом РНГА положительный результат был зафиксирован у 131 животного (титры антител > 1:128). При тестировании «сероположительных» кошек методом ПЦР РНК коронавируса была обнаружена в плазме и асцитной жидкости у 12 животных (9%), только в фекалиях - у 68 (52%) и у 51 (39%) - не обнаружена вовсе. Таким образом, 52% кошек с серопозитивным результатом являлись носителями условно-патогенных штаммов коронавируса, а 39% были здоровы. Очевидно, что исследование методом РНГА дало 63% ложноположительньгх результатов (в пересчете на общее количество исследованных животных).
Заключение
Полученные результаты свидетельствуют о том, что диагностика коронавирусной инфекции кошек традиционным серологическим методом (РНГА) дает более 60% ложноположительных результатов, поскольку не позволяет дифференцировать состояние носительства от истинного заболевания. Кроме того, "сероположительными» считались животные, имевшие контакт с коронавирусом ранее.
Использование метода ПЦР позволило провести дифференциацию условно-патогенных и патогенных штаммов в связи с их раз личной локализацией в организме и отличить состояние носительства от заболевания. Таким образом, данные проведенного исследования говорят о целесообразности использования метода ПЦР для выявления коронавирусов кошек и собак и постановки окончательного диагноза.
Е.А. ЯРАЛОВА, И.Л. ОБУХОВ, ММ РАХМАНИНА, Э.И. ЭЛИЗБАРАШВИЛИ, В.И.УЛАСОВ,
Всероссийский государственный центр качества и стандартизации лекарственных средств для животных и кормов, г. Москва
Принцип ПЦР- исследования
У каждого живого существа, по крайней мере, на нашей планете, есть уникальный «отпечаток» - ДНК (дезоксирибонуклеиновая кислота), которая отвечает за передачу наследственных факторов от предков к потомкам. Структурно эта молекула представляет собой две нити из молекул-азотитых оснований, удерживаемые рядом друг с другом химическими связями и скрученные в спираль (считается, что для компактности). Из курса биологии вы можете помнить такие названия, как аденин (А), гуанин (Г), тимидин (Т) и цитозин (ц). Это 4 нуклеотида, которые и создают последовательность ДНК. Вирусы хранят свою генетическую информацию в другой нуклеиновой кислоте - РНК.
Информация об уже изученных ДНК и РНК хранится в научных базах лабораторий. После того, как был изобретен метод ПЦР, для многих возбудителей различных заболеваний (бактерии, грибки и вирусы) были созданы свои специфические генетические детекторы (праймеры) - уникальные последовательности нуклеотидов, характерных только для конкретного возбудителя. И если поместить их в пробирку с исследуемым материалом, при наличии в нем ДНК или РНК «живых» возбудителей, праймеры запускают реакцию репликации - создания огромного числа копий, которое можно идентифицировать визуально. Т.е. они начинают копировать свою ДНК/РНК десятки раз.
И при подсчете результатов сотрудники лаборатории могут понять, есть ли искомые бактерии и вирусы в исследуемом образце, или нет, именно поэтому результаты ПЦР чаще всего качественные, т.е. «обнаружено» или «не обнаружено».
Читайте также:

