Методика пересадки гемопоэтических стволовых клеток
Обновлено: 05.10.2024

Трансплантация костного мозга (ТКМ) / стволовых кроветворных клеток периферической крови (ТСКК) - метод лечения гематологических, онкологических и аутоиммунных заболеваний, при котором пациенту после проведения интенсивной иммуносупрессивной терапии с применением больших дозы цитостатических препаратов (иммуносупрессантов), вводят предварительно заготовленный костный мозг или стволовые кроветворные клетки периферической крови (СКК). Ежегодно в мире выполняется около 150 000 ТКМ и ТСКК, причем количество операций постоянно увеличивается.
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
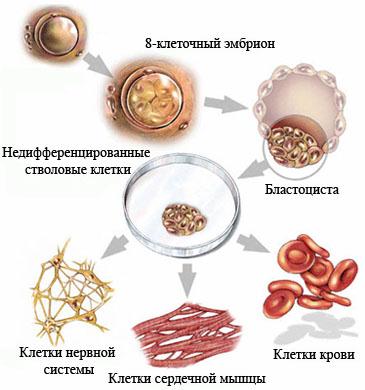
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
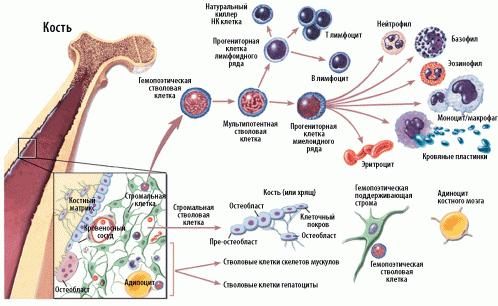
Схема кроветворения и дифференцировки стволовых клеток
 Колонии стволовых кроветворных клеток (электронная микроскопия) | 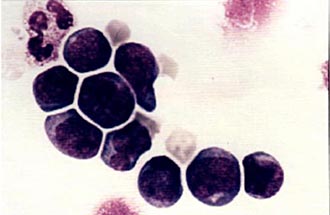 Мононуклеарная фракция, обогащенная клетками CD34, окрашена по Маю-Грюнвальду с докраской по Гимзе. Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты. |
ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d"Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
- 1)аллогенную (АллоТКМ) - при которой больному вводится костный мозг от родственного или неродственного совместимого донора;
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
- 2)аутологичную (АутоТКМ) - когда реципиент получает предварительно заготовленный собственный костный мозг;
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
- 1) острые лейкозы;
- 2) хронический миелолейкоз;
- 3) тяжелая апластическая анемия;
- 4) гемоглобинопатии;
- 5) врожденные иммунодефициты и нарушения метаболизма.
- 1) злокачественные лимфомы;
- 2) некоторые солидные опухоли;
- 3) аутоиммунные заболевания.
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
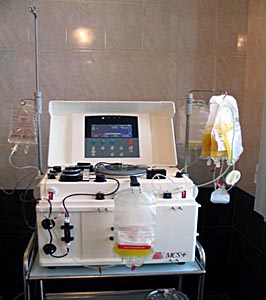
Сепаратор клеток крови
Еще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
- 1) определение показаний и противопоказаний;
- 2) выбор донора (при аллогенной трансплантации);
- 3) получение костного мозга/стволовых клеток их обработка, хранение и введение;
- 4) кондиционирование (иммуносупрессивная терапия);
- 5) профилактика и лечение осложнений периода цитопении;
- 6) профилактика и лечение поздних осложнений.
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
При некоторых заболеваниях трансплантация является методом выбора (тяжелые формы апластической анемии, гемоглобинопатии, врожденных иммунодефицитов и нарушений метаболизма). В ряде случаев ТКМ/ТСКК проводится при солидных опухолях и аутоиммунных заболеваниях. Данная методика имеет возрастные ограничения: АутоТКМ/ТСКК может быть выполнена у лиц моложе 65 лет, АллоТКМ от HLA-идентичного родственника - моложе 55 лет, неродственная АллоТКМ - моложе 50 лет.
- 1) нарушении функции внутренних органов (почек, печени, легких, сердечно-сосудистой системы);
- 2) активной инфекции;
- 3) плохом общесоматическом статусе (индекс ВОЗ > I)
- 4) резистентном к химиотерапии рецидиве солидной опухоли или
- онкогематологического заболевания;
- 5) рефрактерности к трансфузиям тромбоцитов.
ВЫБОР ДОНОРА
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
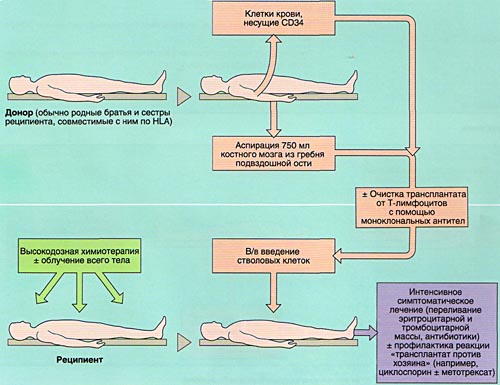
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
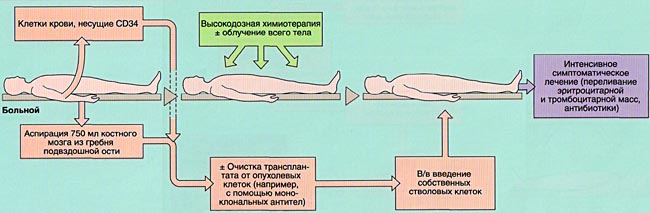
Аспирация костного мозга производится под эндотрахеальным наркозом из задних гребней подвздошной кости, при необходимости - также из передних гребней и грудины. Для этого используют удлиненные иглы типа иглы Кассирского и шприцы объемом 20 см3, содержащие гепарин. Во избежание значительного разведения периферической кровью из каждого прокола кости аспирируют не более 5-6 мл костномозговой взвеси, которую фильтруют и помещают в специальные контейнеры. В каждом контейнере подсчитывают количество ядросодержащих клеток. Для восстановления кроветворения при АутоТКМ требуется получить не менее 1,5x106 ядросодержащих клеток на кг массы тела реципиента, при родственной АллоТКМ - не менее 2х106/кг (у больных апластической анемией - не менее 3х106/кг), при неродственной АлТКМ - не менее 3х106/кг. Объем аспирируемой костномозговой взвеси составляет около 1,5 л.
Для сохранения жизнеспособного костного мозга перед АутоТКМ (между аспирацией и инфузией клеток проходит от 2-3 недель до нескольких лет) после фракционирования его консервируют в жидком азоте под защитой криопротектора (чаще всего - диметилсульфоксида).
 А) |  Б) |
Б) извлеченный из сосуда контейнер с костным мозгом
Инфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.

Инфузия костного мозга пациенту
ИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
Задача кондиционирования - обеспечить глубокую депрессию иммунной системы, а при онкологических заболеваниях и уничтожение оставшихся опухолевых клеток при умеренной токсичности для других органов и систем, а также создании условий для успешного приживления трансплантата.
Для проведения кондиционирования используются стандартные протоколы, в которых указываются дни, часы, дозы и длительность введения цитостатиков, симптоматических препаратов (антибактериальных, седативных, противорвотных и др., объем и характер инфузии), при необходимости - порядок проведения лучевой терапии. Протоколы кондиционирования различаются в зависимости от характера заболевания и типа трансплантации.
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
- 1) помещение больного в стерильный бокс и проведение необходимых санитарно-гигиенических мероприятий (обработка кожи, слизистых оболочек и перианальной области дезинфицирующими растворами);
- 2) подавление микрофлоры кишечника с помощью антибактериальных и противогрибковых препаратов.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).
Приживление костного мозга или СКК периферической крови констатируют по результатам анализа костного мозга. Вскоре количество нейтрофилов достигает > 0,5*109/л, а тромбоцитов > 20>
Трансплантация костного мозга/кроветворных стволовых клеток — эффективный метод лечения заболеваний системы крови, врожденных и приобретенных иммунодефицитов, аутоиммунных заболеваний нервной системы и соединительной ткани, а также отдельных форм злокачественных новообразований у детей и взрослых. Ежегодно в мире выполняется более 50000 трансплантаций костного мозга. Для многих пациентов трансплантация подарила шанс на избавление от страшного недуга. Трансплантация позволяет не только получить длительные и устойчивые ремиссии заболевания, когда традиционное лечение является бессильным, но при ряде заболеваний полностью излечиться от тяжелой болезни.
Технология и виды трансплантации
Технология проведения трансплантации костного мозга или кроветворных стволовых клеток периферической крови предполагает внутривенное введение в организм пациента предварительно забранной у донора или самого пациента и, специально обработанной суспензии костного мозга или стволовых кроветворных клеток периферической крови. Значительно реже, в основном у детей, применяются кроветворные стволовые клетки пуповинной крови. Как правило, проведению трансплантации предшествует интенсивная химиотерапия, основной целью которой является максимальная редукция опухолевых клеток и клеток иммунной системы.
В зависимости от источника трансплантируемых клеток выделяют:
- Аллогенную трансплантацию костного мозга/стволовых кроветворных клеток периферической крови. При этом типе трансплантации источником кроветворных клеток является здоровый человек (донор) имеющий генетическое сходство с пациентом (реципиентом) по определенным генетическим параметрам. Донор может быть родственным (брат, сестра, родители) или неродственным.
- Аутологичную трансплантацию костного мозга/стволовых кроветворных клеток периферической крови — источником стволовых клеток или костного мозга является сам пациент.
- Сингенную трансплантацию костного мозга/стволовых кроветворных клеток периферической крови, которая является видом аллогенной трансплантации. Донором при сингенной трансплантации является монозиготный (генетически сходный) близнец пациента.
Аутологичная трансплантация — это вид трансплантации, при котором пересаживают собственные кроветворные клетки пациента, содержащиеся в костном мозге, периферической или пуповинной крови. С середины годов XX века костный мозг для трансплантации применяется все реже, что обусловлено появлением специальной аппаратуры для получения стволовых клеток из периферической крови (сепараторы стволовых клеток). Сепараторы клеток крови позволили сделать процедуру получения кроветворных стволовых клеток значительно более эффективной и безопасной. Полученный продукт кроветворных стволовых клеток (костный мозг, периферическая кровь, пуповинная кровь), замораживается и хранится необходимое время в среде жидкого азота при -197°С. Размороженные клетки возвращаются (трансплантируются) пациенту путем внутривенной инфузии. Как правило, перед трансплантацией проводится интенсивная химиотерапия, позволяющая максимально удалить опухолевые клетки из организма и преодолеть их лекарственную устойчивость к химиопрепаратам.
Успех трансплантации зависит от активности самого заболевания (состояние ремиссии) и физического состояние пациента (возраст, сопутствующие заболевания, функциональное состояние основных органов и систем).
Показаниями для проведения аутологичной трансплантации являются:
- Лимфома Ходжкина (лимфогранулематоз), неходжкинские лимфомы — трансплантация проводится при неэффективности стандартной терапии или рецидиве (возврате) заболевания.
- Множественная миелома — проводится как один из основных этапов лечения большинству из впервые выявленных пациентов.
- Острые лейкозы — рассматриваются как противопоказание для аутологичной трансплантации за исключением острого промиелоцитарного лейкоза или в рамках исследовательских протоколов.
- Злокачественные опухоли некроветворной системы — рак яичка, некоторые виды сарком (в частности, саркома Юинга), глиобластома у детей.
- Аутоиммунные заболевания — рассеянный склероз, другие аутоиммунные заболевания нервной системы, системная склеродермия, тимома.
Аллогенная трансплантация — вид трансплантации при котором пересаживают донорские кроветворные клетки (костный мозг, кроветворные стволовые клетки периферической крови, кроветворные клетки пуповинной крови), полностью или частично совместимые по генетическому признаку. Вероятность генетического совпадения схожести кроветворной ткани родственников составляет не более 25%. Поэтому в последнее время все чаще используется частично совместимые кроветворные клетки доноров не родственников. Поиск неродственного донора осуществляется в регистре доноров костного мозга, в котором подбирается совместимый с пациентом донор. Совместимость определяется после проведения лабораторных тестов, которые определяют генетический профиль тканей донора и пациента, это исследование называется HLA-типирование — антигены тканевой совместимости (human leucocyte antigens). Для исследования достаточно крови донора и реципиента. В Российской федерации имеются два регистра костного мозга: ФГБУ НМИЦ гематологии Минздрава России, г. Москва и ФГБУ Кировский научно-исследовательский институт гематологии и переливания крови ФМБА России, г. Киров.
Показанием для этого вида трансплантации являются:
- Острые лейкозы и отдельные формы хронических лейкозов — в первую и последующие ремиссии.
- Тяжелая апластическая анемия — при отсутствии эффекта от иммуносупрессивной терапии или рецидив после ее проведения.
- Врожденные иммунодефицитные состояния у детей.
- Рецидивы лимфомы после аутологичной трансплантации.
В клинике гематологии и клеточной терапии им. А.А. Максимова ФГБУ «НМХЦ им. Н.И. Пирогова» Минздрава России выполняется более 200 различных видов трансплантаций кроветворных стволовых клеток. Коллектив клиники, ежедневно заботясь о здоровье пациентов, искренне верит, что трансплантация периферических стволовых кроветворных клеток — это путь к Вашему выздоровлению.

Клетки крови необходимы для жизни. Когда в силу разных причин клетки крови перестают правильно функционировать может понадобиться трансплантация гемопоэтических стволовых клеток крови, костного мозга или пуповинной крови.
При трансплантации гемопоэтические стволовые клетки здорового донора переливаются в кровоток пациента, где они приживаются и начинают производить здоровые эритроциты, лейкоциты и тромбоциты. Систему кроветворения пациента «перезапускают» с помощью подготовительной химиотерапии и иногда облучения всего тела перед трансплантацией. Сама процедура трансплантации в «день 0» выглядит как переливание продуктов крови через внутривенный катетер.
Трансплантация гемопоэтических стволовых клеток - метод лечения, который применяется при тяжелых формах острого лейкоза и других злокачественных болезнях крови, в тех случаях, когда излечение при помощи обычной химиотерапии невозможно.
Четыре основных этапа трансплантации ГСК:



Существуют три основных причины неудачной трансплантации:
1. Рецидив основного заболевания (лейкоза). Риск рецидива заболевания зависит от многих факторов, в первую очередь - от биологических особенностей клеток опухоли и количества опухолевых клеток в организме пациента в момент трансплантации. Если опухолевых клеток мало (пациент находится в ремиссии), вероятность рецидива снижается. Если опухолевых клеток много (рефрактерное течение лейкоза), риск рецидива после пересадки очень большой.
2. Реакция «трансплантат-против-хозяина» (РТПХ) - особое осложнение, при котором донорские Т-лимфоциты, содержащиеся в трансплантате, вызывают сильное воспаление органов у пациента. При острой РТПХ, которая развивается в первые три месяца после пересадки, чаще всего повреждаются кожа, печень и кишечник. При хронической РТПХ, которая развивается через 3-12 месяцев после пересадки, может происходить поражение кожи, суставов, легких, слизистых оболочек, печени, желудка и кишечника. РТПХ - самое тяжелое осложнение пересадки кроветворных стволовых клеток, приводящее к смерти 5-15% пациентов после трансплантации.
3. Тяжелые инфекции, развитие которых связано с плохой работы иммунной системы в первые месяцы после трансплантации. У некоторых пациентов вирусная, грибковая или бактериальная инфекция могут стать причиной смерти.
Читайте также:

